EN ISO 13485:2016 – Certificazione dei sistemi di gestione della qualità dei produttori di dispositivi medici, dei rispettivi fornitori e di altre figure operanti nel settore dei dispositivi Medici
Un sistema di gestione della qualità efficiente e conforme alle norme è di fondamentale importanza nel settore della tecnica medicale. La certificazione secondo EN ISO 13485:2016 attesta il rispetto dei massimi standard e contribuisce in misura sostanziale a rafforzare la fiducia dei vostri stakeholder.

Accreditamento da parte del Servizio di accreditamento svizzero (SAS)

I nostri certificati sono validi e riconosciuti a livello internazionale

Certifichiamo sistemi di gestione dal 1983

Intorno a 7 000 clienti si fidano dei nostri servizi
Sistemi di gestione della qualità dei dispositivi medici secondo EN ISO 13485
Produzione di dispositivi medici sicuri e di qualità eccellente. I produttori di dispositivi medici e i rispettivi fornitori sono tenuti a predisporre e a mantenere un sistema di gestione della qualità, richiedendone all’occorrenza la certificazione da parte di un organismo indipendente.
Gruppo target della EN ISO 13485
Società industriali e di servizi nel settore dei dispositivi medici.
Durata di validità del certificato
3 anni – nell’ottica di uno sviluppo continuo, ogni anno si tiene un audit di mantenimento e dopo 3 anni si svolge un audit di ricertificazione
Riconoscimento del certificato SQS
Il certificato di SQS ISO 13485 è valido a livello internazionale ed è riconosciuto in tutto il mondo attraverso l’adesione a IQNET.
Il responsabile del prodotto è a vostra disposizione

Lucas Pfeifer
Avete domande su una determinata norma o sui nostri servizi? Desiderate ricevere maggiori dettagli sul processo di certificazione e sui costi associati? Oppure possiamo sottoporvi un’offerta concreta per la vostra certificazione?
Siamo a vostra completa disposizione. Io, in veste di responsabile di prodotto, insieme al nostro Account management, saremo lieti di darvi informazioni o di inoltrare le vostre domande ai nostri auditor esperti. Il nostro obiettivo è semplificarvi il più possibile l’accesso ai sistemi di gestione certificati.
Fateci sapere come possiamo assistervi. Vi aspettiamo!
Cordiali saluti,
Lucas Pfeifer
Un contributo alla sicurezza dei pazienti
Un sistema GQ certificato secondo EN ISO 13485 fa sì che i processi di produzione, monitoraggio e tracciabilità dei dispositivi medici e dei rispettivi componenti vengano pianificati, eseguiti e valutati in modo efficace. Ciò promuove il rispetto costante dei requisiti in termini di sicurezza, prestazioni e conformità, fornendo un contributo sostanziale alla sicurezza dei pazienti.
Un contesto affidabile per la collaborazione
La ISO 13485 crea le basi per processi stabili e una tracciabilità completa dallo sviluppo fino alla consegna. I rischi vengono rilevati e controllati in modo metodico e le evidenze tecniche sono documentate e costantemente verificabili.
Processi chiari e ottimizzati
La norma presuppone processi, documentazioni e meccanismi di controllo sistematici e basati sul rischio. Ciò permette di riconoscere e attuare soluzioni di ottimizzazione per tempo. Queste condizioni, a loro volta, promuovono il miglioramento continuo e rafforzano la consapevolezza nei confronti della qualità a livello di azienda.
Se ritenete di essere conformi alla norma, potete iscrivervi direttamente per la certificazione utilizzando il modulo qui sopra. Opzionalmente, potete seguire l’iter descritto di seguito per ottenere la certificazione ISO 13485:
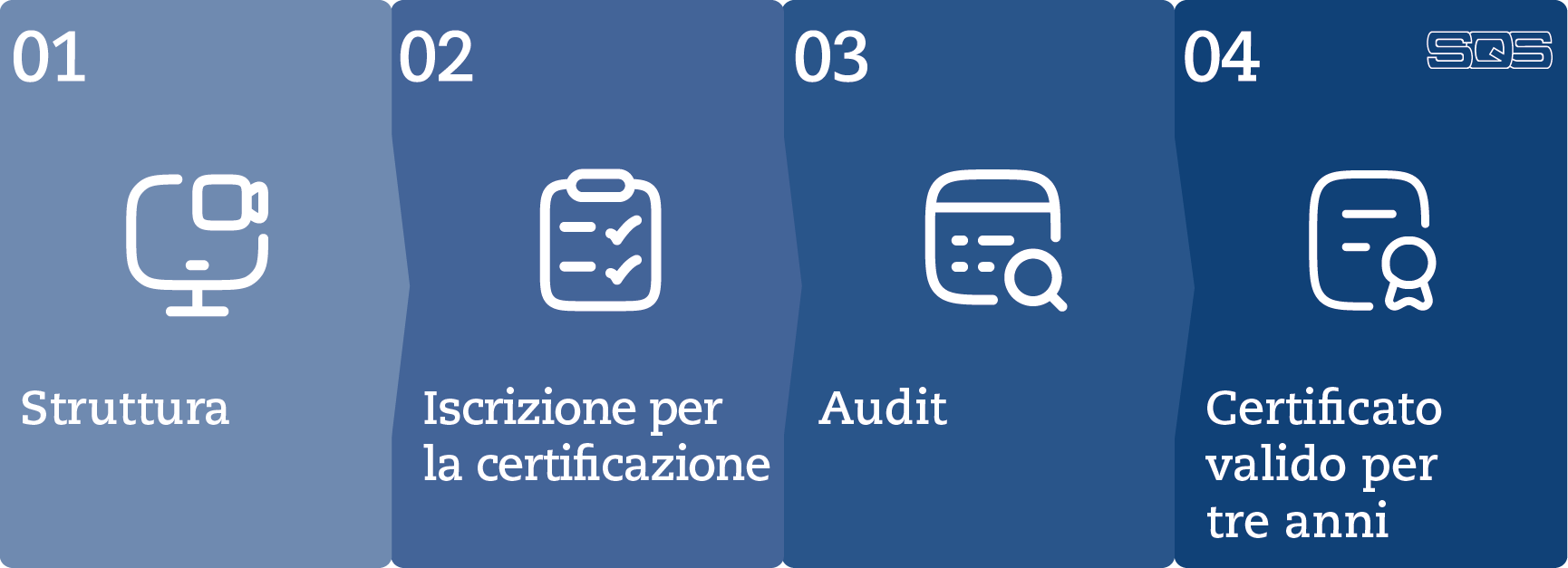
#1 – Struttura
Implementate il vostro sistema di gestione nel pieno rispetto della norma: sarete così preparati al meglio per il vostro primo audit di certificazione esterno a cura di SQS.
#2 – Iscrizione per la certificazione
Dopo l’iscrizione per la certificazione, potete beneficiare di un colloquio preliminare o di un pre-audit. Il pre-audit identifica le lacune rilevanti per il sistema e consente una certificazione efficiente.
#3 – Audit
Per prima cosa esaminiamo la documentazione del vostro sistema, valutiamo la vostra predisposizione alla certificazione e redigiamo insieme a voi un piano d’audit dettagliato. In seguito, i nostri auditor si recano presso la vostra azienda per ispezionare gli oggetti di prova rilevanti o il grado di maturità del sistema di gestione e redigono un rapporto.
#4 – Certificato valido per tre anni
Se il rapporto è positivo, riceverete il certificato in formato digitale e cartaceo. Potrete così divulgarlo internamente ed esternamente all’azienda per un periodo di tre anni. Gli audit annuali assicurano la conformità alla norma e consentono miglioramenti continui. La ricertificazione completa avviene dopo tre anni.
Dipende dalle dimensioni dell’azienda, dalla complessità dei prodotti e dal grado di preparazione. Una documentazione ben strutturata, processi definiti e responsabilità chiare possono accelerare il processo di certificazione.
Il certificato è valido per tre anni. Nell’arco di questo tempo, ogni anno viene svolto un audit di mantenimento. Allo scadere dei tre anni avviene un audit di ricertificazione per mantenere lo stato.
I costi variano in funzione delle dimensioni dell’azienda, del portafoglio di prodotti, della classe di rischio dei prodotti e dei siti. Saremo lieti di sottoporvi un’offerta personalizzata sulla base dei vostri requisiti specifici.
No, la nostra competenza chiave è la certificazione. Trovate la nostra offerta formativa attuale sul nostro sito web.
Ogni certificato è munito di un numero di registrazione univoco. Terzi interessati possono verificarne la validità presso un organismo di certificazione come SQS, IQNET o nei database corrispondenti. Alla consultazione
Se nel corso di un audit vengono riscontrate delle non conformità, si dà all’azienda un termine entro il quale deve implementare azioni correttive. Se ciò non avviene, il certificato non potrà essere rilasciato o rinnovato o dovrà essere ritirato.
EN ISO 13485 incorpora elementi della ISO 9001 e presenta in aggiunta requisiti supplementari relativamente alla sicurezza dei dispositivi medici, alla gestione del rischio, alla validazione, alla tracciabilità e alla documentazione. I sistemi di gestione integrati combinano diverse norme riducendo l’onere organizzativo.
Mentre EN ISO 13485 è una norma per i sistemi di gestione della qualità, il regolamento UE (ad es. MDR 2017/745) stabilisce i requisiti prestazionali e di sicurezza fondamentali per i dispositivi medici. Una certificazione di successo secondo EN ISO 13485 può semplificare la valutazione della conformità, ma non potrà sostituire tutti i requisiti normativi.
Una certificazione indica a clienti, partner commerciali e autorità che una determinata azienda soddisfa in modo coerente i requisiti in termini di sicurezza e qualità dei dispositivi medici. Ciò rafforza la fiducia nel marchio e può contribuire in modo decisivo al successo sui mercati nazionali e internazionali.

